Thermodynamik ist der Zweig der Physik, der die Beziehung zwischen Wärme und anderen Energieformen untersucht. Sie konzentriert sich insbesondere auf die Energieübertragung und -umwandlung und kann viel zu den Bereichen Chemie und Maschinenbau, physikalische Chemie und Biochemie beitragen.
Der Begriff „Thermodynamik“ wurde wahrscheinlich zuerst von dem mathematischen Physiker William Thompson, auch bekannt als Lord Kelvin, in seiner Arbeit geprägt.Über die dynamische Wärmetheorie 1854.
Die moderne Thermodynamik basiert auf vier Gesetzen:
- Dernullter Hauptsatz der Thermodynamik besagt, dass, wenn zwei unabhängige thermodynamische Systeme mit einem dritten System im thermischen Gleichgewicht sind d.h. es gibt keinen Nettofluss von thermischer Energie zwischen ihnen, dann sind sie auch miteinander im thermischen Gleichgewicht.
- Dererster Hauptsatz der Thermodynamik, auch bekannt als Energieerhaltungssatz, Staaten diese Energie kann nicht erzeugt oder zerstört, sondern nur umgewandelt oder übertragen werden.
- Derzweiter Hauptsatz der Thermodynamikbestätigt, dass die Entropie eines isolierten Systems nimmt mit der Zeit immer zu.
- Derdritter Hauptsatz der Thermodynamik legt fest, dass sich die Entropie eines Systems einem konstanten Wert annähert, wenn sich die Temperatur dem absoluten Nullpunkt nähert.
In diesem Artikel konzentrieren wir uns auf die erster und zweiter Hauptsatz der Thermodynamik.
Was sind dieerster und zweiter Hauptsatz der Thermodynamik?
Der erste Hauptsatz der Thermodynamik ist auch bekannt als der Energieerhaltungssatz. Da die Energie nicht erzeugt oder zerstört werden kann, ist die Gesamtenergie eines isoliertes System wird deshalb immer konstant sein und kann nur in eine andere Energieform umgewandelt oder an eine andere Stelle im System übertragen werden.
Die Formel des ersten Hauptsatzes der Thermodynamik ist ΔU = Q − W, wobei ΔU die Änderung der inneren Energie U des Systems ist, Q die in das System übertragene Nettowärme die Summe aller Wärmeübertragungen des Systems, und W ist die vom System geleistete Netzarbeit die Summe aller am oder vom System geleisteten Arbeiten.
Der zweite Hauptsatz führt den Begriff von ein Entropie in der Thermodynamik. Entropie ist eine physikalische Eigenschaft, die misstdie Menge an thermischer Energie in einem System, die für die Verrichtung nützlicher Arbeit nicht verfügbar ist. Die Energie, die keine Arbeit verrichten kann, wird in Wärme umgewandelt, und die Wärme erhöht die molekulare Unordnung des Systems. Die Entropie kann auch als Maß für diese Unordnung angesehen werden.
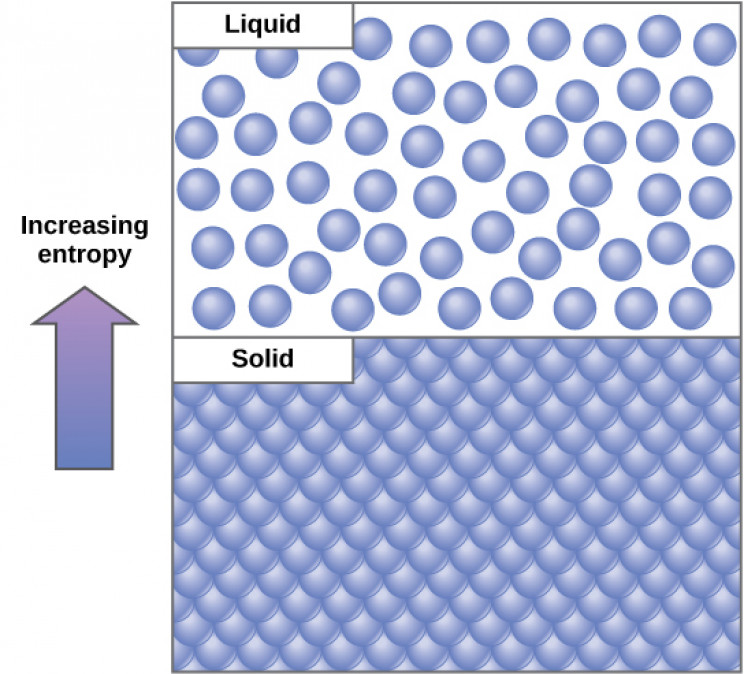
Der zweite Hauptsatz der Thermodynamik besagt, dass die Entropie immer zunimmt. Dies liegt daran, dass in jedem isolierten System immer eine gewisse Energiemenge vorhanden ist, die nicht zur Verfügung steht, um Arbeit zu verrichten. Folglich wird immer Wärme produziert und dies erhöht natürlich die Unordnung oder Entropie des Systems.
Die zunehmende Entropie ΔS entspricht dem Wärmeübergang ΔQ geteilt durch die Temperatur T. Deshalb lässt sich der zweite Hauptsatz der Thermodynamik mit der Formel ΔS =ΔQ / T ausdrücken.
Wer hat die Gesetze der Thermodynamik entdeckt?
Wie oben erwähnt, hängt der erste Hauptsatz der Thermodynamik eng mit dem Energieerhaltungssatz zusammen, der erstmals 1842 von Julius Robert Mayer formuliert wurde. Mayer erkannte, dass eine chemische Reaktion Wärme und Arbeit erzeugt und dass Arbeit dann eine bestimmte Menge erzeugen kannObwohl dies im Wesentlichen eine Aussage zur Energieeinsparung ist, war Mayer nicht Teil des wissenschaftlichen Establishments und seine Arbeit wurde einige Jahre lang ignoriert.
Stattdessen würden der deutsche Physiker Rudolf Clausius, der irische Mathematiker William Thomson Lord Kelvin und der schottische Maschinenbauingenieur William Rankine ab etwa 1850 eine größere Rolle bei der Entwicklung der Wissenschaft der Thermodynamik und der Anpassung der Energieerhaltung an thermodynamische Prozesse spielen.
Der zweite Hauptsatz der Thermodynamik hat seinen Ursprung in der Arbeit des französischen Maschinenbauingenieurs Nicolas Léonard Sadi Carnot, der Dampfmaschinen studierte. Er wird oft als der Vater der Thermodynamik angesehenwegen seinem BuchReflexionen über die Motivkraft des Feuers1824, das eine theoretische Diskussion über die perfekte aber unerreichbare Wärmekraftmaschine präsentierte.
In diesem Buch schrieb Sadi Carnot eine frühe Aussage des zweiten Hauptsatzes der Thermodynamik, die mehr als vierzig Jahre später von Rudolf Clausius neu formuliert wurde. Auch andere Wissenschaftler trugen zur Definition des Gesetzes bei: der bereits erwähnte Lord Kelvin 1851, deutscher MathematikerMax Planck 1897 und der griechische Mathematiker Constantin Carathéodory 1909.
Laut Wissenschaftler für Wärmewissenschaften Jayaraman Srinivasan, die Entdeckung des ersten und zweiten Hauptsatzes der Thermodynamik war revolutionär in der Physik des 19. Jahrhunderts.
Der dritte Hauptsatz der Thermodynamik wurde zu Beginn des 20. Jahrhunderts vom deutschen Chemiker Walther Nernst entwickelt. Nernst zeigte, dass die maximal erreichbare Arbeit eines Prozesses aus der Wärmeentwicklung bei Temperaturen nahe dem absoluten Nullpunkt berechnet werden kann. Der nullte Hauptsatz hattewurde seit den 1870er Jahren untersucht, wurde aber in den 1900er Jahren als separates Gesetz definiert.
Wie hängen der erste und der zweite Hauptsatz der Thermodynamik zusammen?
Der erste und der zweite Hauptsatz der Thermodynamik sind unabhängig voneinander, denn der Entropiesatz lautet nicht direkt aus dem Energieerhaltungssatz abgeleitet oder abgeleitet oder umgekehrt.
Aber gleichzeitig ergänzen sich die beiden Gesetze, denn während der erste Hauptsatz der Thermodynamik die Übertragung oder Umwandlung von Energie beinhaltet, spricht der zweite Hauptsatz der Thermodynamik über die Richtungsabhängigkeit physikalischer Veränderungen – wie isoliert oder geschlossenes Systems bewegen sich von niedriger zu höherer Entropie aufgrund der Energie, die nicht für Arbeit verwendet werden kann.
Mit anderen Worten, der zweite Hauptsatz der Thermodynamik berücksichtigt die Tatsache, dass die im ersten Hauptsatz der Thermodynamik beschriebene Energieumwandlung immer etwas zusätzliche, „nutzlose“ Energie freisetzt, die nicht in Arbeit umgewandelt werden kann.
Warum sind der erste und der zweite Hauptsatz der Thermodynamik wichtig?
Die Gesetze der Physik erklären, wie Naturphänomene und Maschinen funktionieren. Diese Erklärungen befriedigen nicht nur unsere Neugier, sondern ermöglichen uns auch, Phänomene vorherzusagen. Tatsächlich helfen sie uns, funktionale Maschinen zu bauen.
Die Thermodynamik als Teilgebiet der Physik ist hier keine Ausnahme. Wenn man weiß, wie viel Energie in einem System für Arbeit verwendet werden kann und wie viel in Wärme umgewandelt wird und es gibt immer eine gewisse Menge an „nutzloser“ Energie inein System, können Sie vorhersagen, wie viel Wärme eine bestimmte Maschine unter verschiedenen Bedingungen produzieren wird. Dann können Sie entscheiden, was mit dieser Wärme geschehen soll.
Wärme ist eine Form von Energie und wenn Sie wissen, dass Energie nicht zerstört, sondern nur umgewandelt werden kann, könnten Sie einen Weg finden, diese thermische Energie in mechanische Energie umzuwandeln – was tatsächlich Wärmekraftmaschinen tun.
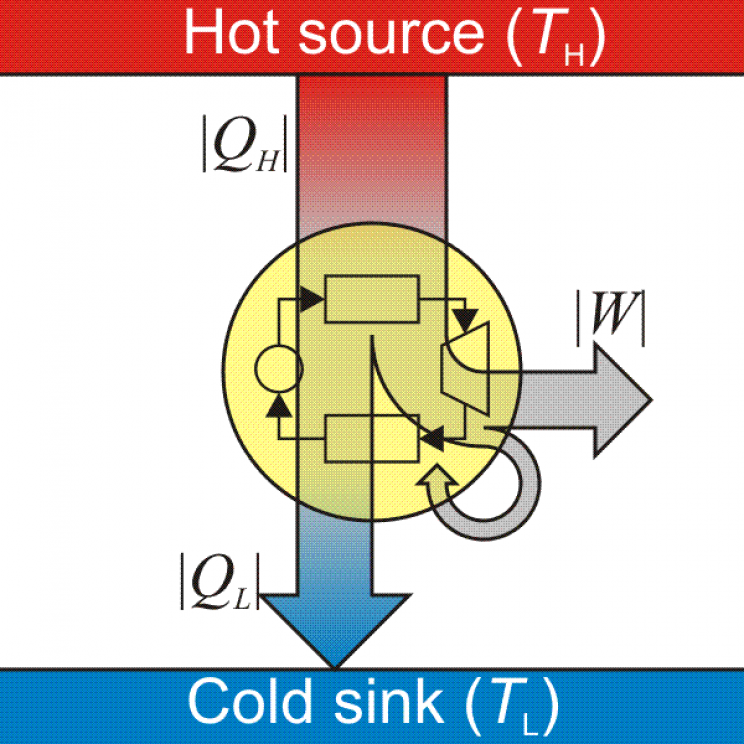
Angesichts dieser grundlegenden Anwendung des ersten und zweiten Hauptsatzes der Thermodynamik, Sie können sich wahrscheinlich vorstellen, wie nützlich sie im Ingenieurbereich sein können. Aber sie können auch Bewerbungen in habenChemie, Kosmologie Entropie sagt den eventuellen Hitzetod des Universums voraus, Atmosphärenwissenschaften, Biologie Pflanzen wandeln bei der Photosynthese Strahlungsenergie in chemische Energie um und viele andere Bereiche.Daher die Bedeutung der Thermodynamik
Können Sie die ersten beiden Gesetze der Thermodynamik brechen?
Um den ersten Hauptsatz der Thermodynamik zu brechen, müssten wir eine "Perpetuum Mobile"-Maschine schaffen, die ohne jegliche Energiezufuhr kontinuierlich arbeitet. Das gibt es noch nicht. Alle Maschinen, die wir kennen, beziehen Energie voneine Quelle thermisch, mechanisch, elektrisch, chemisch usw. und wandeln sie in eine andere Energieform um. Zum Beispiel wandeln Dampfmaschinen thermische Energie in mechanische Energie um.
Um den ersten Hauptsatz der Thermodynamik zu brechen, müsste das Leben selbst neu gedacht werden. Auch Lebewesen existieren in Übereinstimmung mit dem Energieerhaltungssatz. Pflanzen nutzen Photosynthese, um „Nahrung“ chemische Energie für ihren Gebrauch herzustellen, und Tiere undMenschen essen, um zu überleben.
Essen ist im Grunde genommen die Gewinnung von Energie aus der Nahrung und deren Umwandlung in chemische Energie als Glukose gespeichert, die uns tatsächlich „Energie“ gibt. Wir wandeln diese chemische Energie in mechanische Energie um, wenn wir uns bewegen, und in thermische Energie, wenn wir unsere regulierenKörpertemperatur usw.
Aber in der Quantenwelt mag die Sache etwas anders sein. 2002 zeigten Chemiephysiker der Australian National University in Canberra, dass der zweite Hauptsatz der Thermodynamik auf atomarer Ebene kurzzeitig verletzt werden kann. Die Wissenschaftler gaben Latexkügelchen in Wasser undfingen sie mit einem präzisen Laserstrahl ein und maßen regelmäßig die Bewegung der Perlen und die Entropie des Systems und beobachteten, dass die Entropieänderung war über Zeitintervalle von einigen Zehntelsekunden negativ.
In letzter Zeit, Forscher, darunter einige, die an Googles Quantenprozessor Sycamore arbeiten, haben "Zeitkristalle" erstellt, eine Phase außerhalb des Gleichgewichts der Materie, die auf unbestimmte Zeit zwischen zwei Energiezuständen zirkuliert, ohne Energie an die Umgebung zu verlieren. Diese Nanopartikel erreichen nie das thermische Gleichgewicht. Sie bilden ein Quantensystem, das seine Entropie nicht zu erhöhen scheint – was den zweiten völlig verletztGesetz der Thermodynamik.
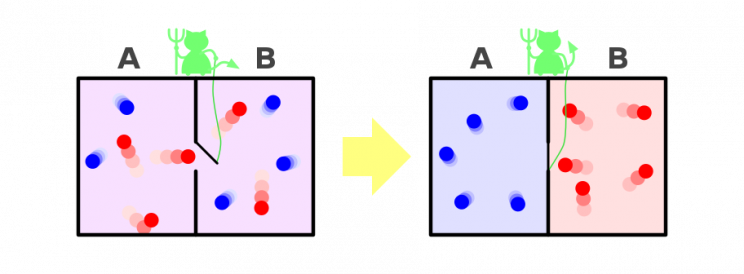
Dies ist eine reale Demonstration von Maxwells Dämon, ein Gedankenexperiment, um den zweiten Hauptsatz der Thermodynamik zu brechen.
Das Experiment wurde 1867 vom schottischen Mathematiker James Clerk Maxwell vorgeschlagen und bestand darin, einen Dämon in die Mitte von zwei Gaskammern zu setzen. Der Dämon kontrollierte eine masselose Tür, die es den Kammern ermöglichte, Gasmoleküle auszutauschen. Aber da sich der Dämon öffnete undschloss die Tür so schnell, dass in die eine Richtung nur schnell bewegte Moleküle und in die andere nur langsam bewegte Moleküle durchgelassen wurdenohne Arbeit.
Obwohl wir immer noch nicht genau wissen, wie man Zeitkristalle verwendet, gilt dies bereits als revolutionäre Entdeckung in der Physik der kondensierten Materie. Zeitkristalle könnten die Quantencomputertechnologie zumindest erheblich verbessern.
Aber es gibt auch etwas an dem Konzept des „Perpetuum Motion ohne Energieeinsatz“, das futuristische Köpfe unweigerlich dazu bringt, sich Perpetuum Mobile Quantengeräte vorzustellen, die keine zusätzliche Energiezufuhr benötigen – wie zum Beispiel ein nicht angeschlossener Kühlschrank, der immer noch in der Lage istKühlen Sie Ihr Essen ab; oder eher Science-Fiction, a Supercomputer, der die Simulation aufrechterhält, in der wir leben könnten.
