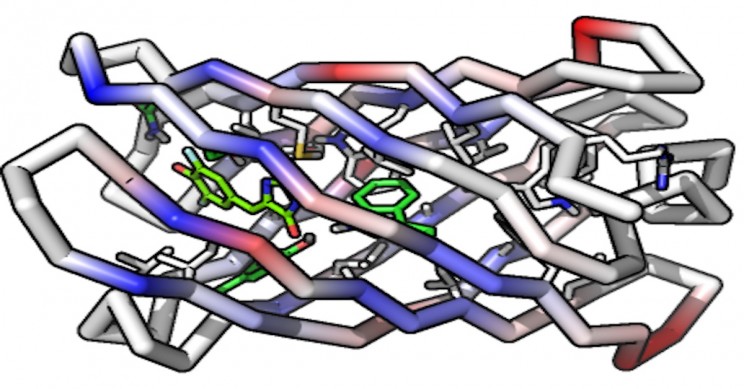
Forscher haben zum ersten Mal erfolgreich ein Protein von Grund auf neu entwickelt, das an ein kleines Zielmolekül binden kann. Wissenschaftler aus der Universität der Washington School von Medicine wurde ein zylindrisches Protein namens Beta-Barrel entwickelt, das einen Hohlraum zum Binden des Ziels aufweist.
Das erzeugte Protein war in der Lage, "eine Verbindung zu binden und zu aktivieren, die der im grün fluoreszierenden Protein enthaltenen ähnlich ist". Dies ist ein großer Fortschritt für die Wissenschaft, in der frühere Versuche, niedermolekulare Bindungsproteine herzustellen, durch die Praxis eingeschränkt warenvon Proteinen, die bereits in der Natur vorhanden sind.
Anwendungen in Medizin und Industrie
Dieser jüngste Durchbruch öffnet Wissenschaftlern die Möglichkeit, Proteine herzustellen, die ihresgleichen in der Natur suchen. Kundenspezifische Proteine können mit hoher Präzision hergestellt werden und an bestimmte niedermolekulare Ziele binden und auf diese einwirken.
Diese Technik von Grund auf neu oder "de novo" hat potenzielle Anwendungen in Forschung, Medizin und Industrie. "Das erfolgreiche De-novo-Design von maßgeschneiderten Proteinen mit niedermolekularer Bindungsaktivität bildet die Grundlage für die Schaffung immer ausgefeilterer BindungsproteineDies wird nicht die Einschränkungen aufweisen, die bei Proteinen auftreten, die durch Veränderung bestehender Proteinstrukturen entwickelt wurden ", so der leitende Autor David Baker. erklärt.
Spezialsoftware zur Vorhersage der Proteinform
Bevor die Wissenschaftler überhaupt anfangen konnten, das Protein von Grund auf neu herzustellen, mussten sie zunächst ein zylinderförmiges Protein namens Beta-Barrel von Grund auf neu herstellen. Die Form ist perfekt für die Aufgabe, da ein Ende des Zylinders das Protein stabilisiert, während der andere als Bindungsstelle für das Zielmolekül fungiert.
Der Wissenschaftler verwendete eine im Baker-Labor entwickelte Softwareplattform namens Rosetta, um das neue Protein zu entwerfen. Das Programm kann vorhersagen, welche Form eine Kette von Aminosäuren nach der Synthese annehmen wird, und dabei helfen, vorherzusagen, wie sich einzelne Aminosäuren entlang des Proteins verändernKette kann die endgültige Form verändern.
Diese Vorhersagekraft ermöglicht es, verschiedene Kombinationen von Aminosäuren zu testen, um ein Protein mit der gewünschten Form und Funktion zu entwerfen. Zusätzlich zu dieser Vorhersage-Software verwendete der Wissenschaftler einen leistungsstarken neuen Docking-Algorithmus namens "Rotamer Interaction Field""RIF, entwickelt von William Sheffler, einem leitenden Wissenschaftler in der Baker Lab.
Der Algorithmus 'identifiziert alle potenziellen Strukturen von Hohlräumen, die die Voraussetzungen für die Bindung spezifischer Moleküle erfüllen.' Mithilfe des Algorithmus und des Softwareprogramms entwickelte der Wissenschaftler erfolgreich sein maßgeschneidertes Protein, das die DFHBI-Verbindung eifrig binden und aktivieren kann.
"Es hat in Bakterien-, Hefe- und Säugetierzellen funktioniert", sagte Dou, "und die Hälfte der Größe des grün fluoreszierenden Proteins sollte für Forscher sehr nützlich sein", sagte Baker, dass der Ansatz es Forschern ermöglichen wird, einen effektiv unbegrenzten Satz von Zellen zu erforschenRückgratstrukturen mit Formen, die so angepasst sind, dass sie das interessierende Molekül binden.
"Ebenso wichtig", er hinzugefügt "Es verbessert unser Verständnis der Determinanten der Proteinfaltung und -bindung erheblich über das hinaus, was wir aus der Beschreibung bestehender Proteinstrukturen gelernt haben."
Via : UW